如何更好的理解光谱流式中的扩散误差(Spreading Error)

上篇:原理篇
光谱流式细胞仪可捕获荧光染料的完整发射光谱,从而实现对弱表达marker的检测和重叠荧光信号的分离。然而,当来自不同荧光染料的信号未被准确分离时,光谱流式结果可能会受到解混误差(Unmixing error)和溢出扩散误差(Spillover spreading error)的影响,进而导致数据质量不佳,这些问题在复杂的多色Panel中尤为常见。CytoFLEX mosaic光谱检测模块利用高分辨率光谱数据和单染样本对照,通过先进的光谱解析算法,为准确的识别和解析不同荧光染料,提供了更好的解决方案。
Unmixing Error
在光谱流式细胞仪中,当我们在使用更多颜色的Panel时,遇到的一大挑战就是Unmixing Error(如图1)。这个问题源于荧光染料的光谱在参考对照与实验样品中的不准确匹配。因为光谱流式细胞仪依靠算法来解析具有重叠发射光谱的荧光染料,因此即使很小的光谱不匹配也会导致数据的显著误差。
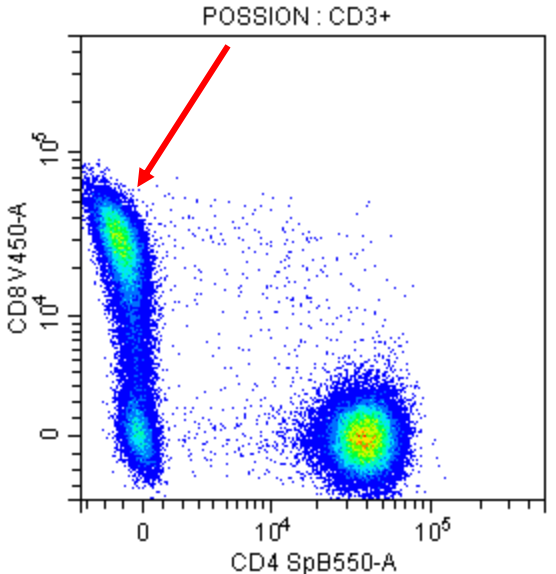
图1:Unmixing Error示例,如箭头指示,在细胞群中表现为倾斜的模式
Unmixing Error严重的后果之一是Spreading Error的增加,即来自明亮荧光染料的信号被错误地分配到其他检测通道。这种错误分配会导致背景噪声升高,降低弱表达或稀有细胞群的分辨能力,引起实验结果的灵敏度和分辨率总体下降。
Unmixing Error会扭曲荧光强度分布,导致信号分配不准确;设门不正确,以及样品或实验之间的可变性增加,比如样本制备的重复性等,这些因素共同降低了实验数据的可靠性和重复性。
值得注意的是,虽然光谱不匹配是Unmixing Error的主要驱动因素,但其他因素包括不合适的单染对照,串联染料的不稳定性,自发荧光的产生,仪器稳定性和不合适的光谱矩阵计算同样也会有影响(如图2所示)。因此更好的应对Unmixing Error需要谨慎注意Panel设计,荧光染料的选择,以及使用能更好匹配实验样本的高质量单染对照。

图2:Overview of Unmixing Error in Flow Cytometry. This schematic diagram illustrates the concept of Unmixing Error through three interconnected sections: Causes, Consequences, and Mitigation
Spillover Spreading Error
溢出扩散误差(Spillover Spreading Error) ,源于荧光检测的物理和统计性质。当一种荧光基团的信号在其他检测器中引入了可变性或增加了测量噪声,由于共享光谱区域,会导致信号分布更加发散,使分辨弱表达或稀有细胞群体的能力下降,尤其是当标志物为共表达时。(如图3示例)

图3:Spillover Spreading Error示例。此处的扩散误差被视为一种“鱼尾状模式",其中PE-CY5信号溢出到Alexa Fluor647中中,导致CD3+CD56-的信号失真并使细胞群显得比实际更宽,进一步加剧了信号重叠,降低了CD3+CD56+ NKT细胞群的分辨率
Spillover Spreading Error的产生包含多种因素:
光子检测的泊松分布性质:其中较亮的信号固有地产生更多统计误差
检测系统的电子噪音
光谱重叠,特别是与明亮的荧光团或高表达的标志物共享探测器
因此即使的光谱解析,Spillover Spreading Error也无法消除,在高维多色实验和共表达标记的分析中影响尤为明显。
如何减轻Spillover Spreading Error的影响:
合理的Panel设计非常关键:共表达markers间的荧光素选择应尽量减少扩散误差
使用适当的对照,如荧光减一对照(FMO),有助于确定荧光扩散误差对设门精度的影响
下表总结了影响光谱流式细胞术中Spillover Spreading Error的综合因素。


下篇:应用篇
除了荧光染料,样本因素,仪器因素,对照设置的因素以外,光谱拆分算法对于Spillover Spreading Error的降低也发挥了重要的作用。CytoFLEX mosaic光谱模块为用户提供了两种分解算法:经典的LSM和贝克曼库尔特生命科学专有的混合泊松算法。
LSM算法是简单和被广泛使用的方法。它假设噪声出现在所有通道的水平是均一的,无论信号强度如何,所有检测器都具有相同的信号强度方差。然而在实际情况下,这种假设通常不成立。比如检测器在不同波段的噪音,以及抗体带来的噪音等,因此导致解析的误差,进而加剧数据的溢出扩散误差(Spillover Spreading Error)。
混合泊松算法是基于光子发射的随机性(泊松统计),对噪音信号进行建模,提供了更真实的信号变异性反馈。
针对同一组样本,这两种算法的表现如何,我们通过一个案例研究来展示。
案例研究:10色方案设计挑战
以下的10色实验采用新鲜人外周血样本,通过染色和裂红处理,并在CytoFLEX LX mosaic光谱流式细胞仪上进行了检测,采用两种光谱分解算法最小二乘法(LSM)和混合泊松算法(Poisson Hybrid)分别分析结果。
结果
左右滑动查看更多
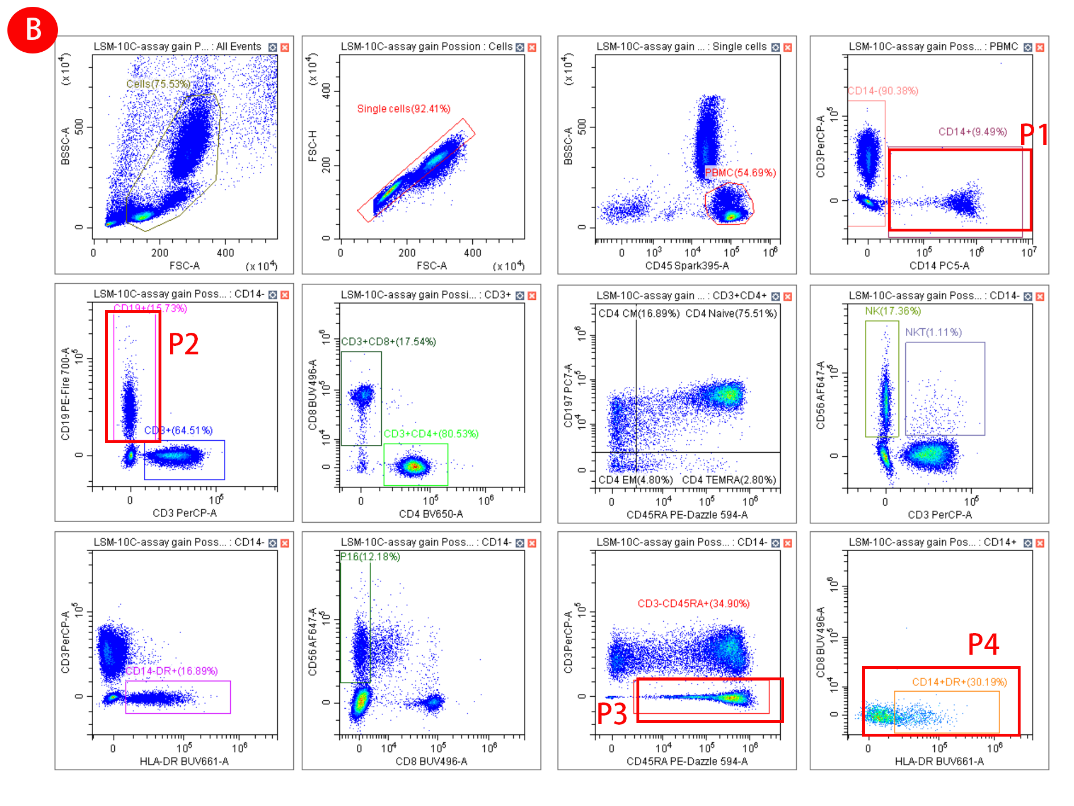
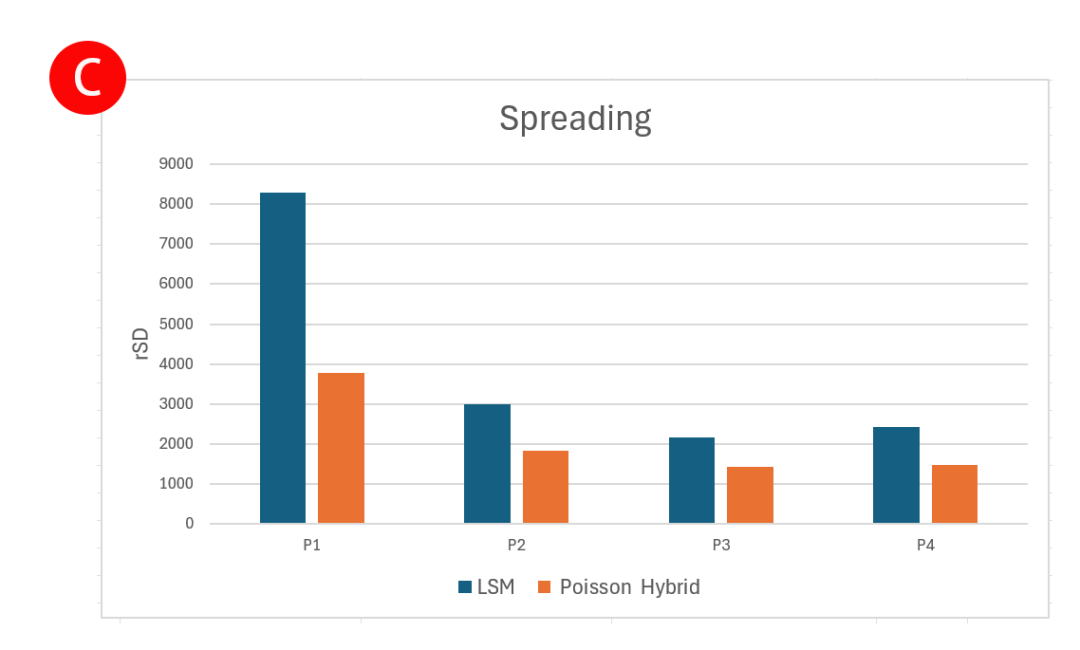
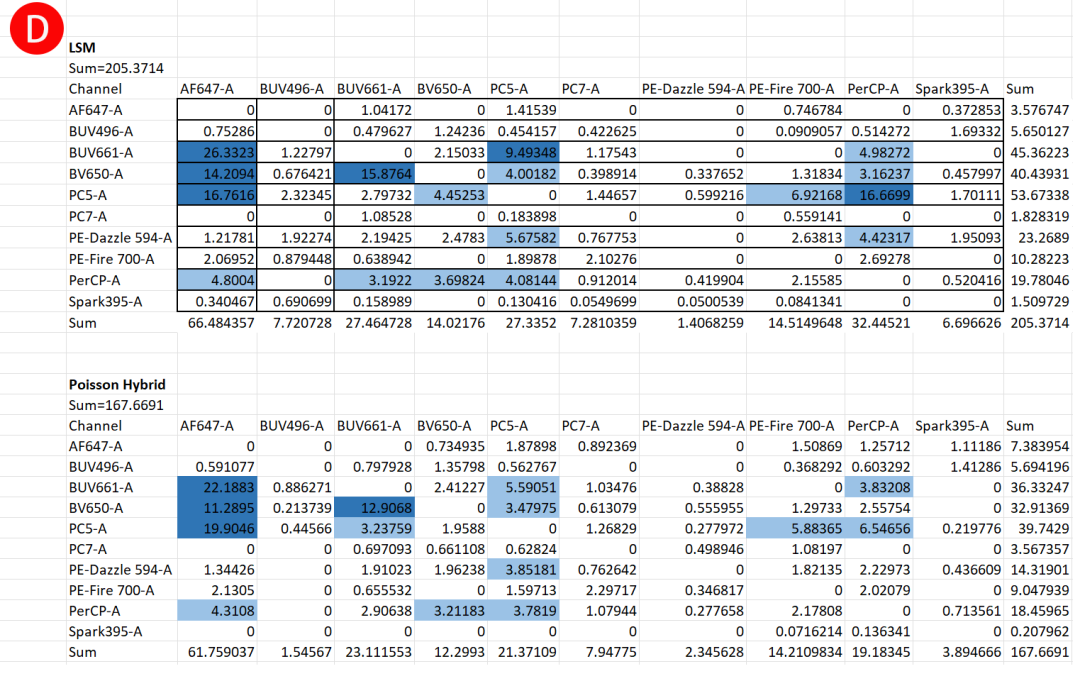
图4:混合泊松算法与LSM算法在减少扩散误差方面的比较。使用一个10色Panel检测人外周血中的主要细胞亚群,并使用混合泊松算法和LSM算法进行解混。(A) 使用LSM(最小二乘法)算法解混的设门数据。(B) 使用混合泊松算法解混的设门数据。(C) 为所选门计算的相对标准偏差 (rSD) 表明混合泊松算法减少了扩散,突显了仅靠溢出扩散矩阵 (SSM) 评估分数未能捕捉到的分辨率改善。(D) 比较两种算法的SSM表显示各检测器的扩散分数差异
图4A为LSM和图4B为混合泊松算法,细胞群P1,P2,P3和P4表现出两种解析算法之间信号扩散的明显差异。图4C定量地说明了不同算法下通道间信号扩散误差的差异。在光谱解析中,阴性信号的rSD很重要,因为它反映了信号分离的一致性和准确性,较低的rSD值表明细胞群更紧密,这对于高维流式细胞术中细胞群的准确识别和定量至关重要。图4D所示的溢出扩散矩阵 (SSM) 用于测量一个荧光染料的信号干扰到其他检测通道的程度,较低的SSM值意味着荧光染料之间的干扰较小,从而产生更干净的数据、更好的细胞群分离和更可靠的分析结果。以上结果均显示,混合泊松算法提高了光谱解析的效率和准确性。
需要注意的是,无论使用的抗体是否经过滴定,此处显示的结果在使用具有更多荧光染料、高度重叠染料或不同类型样品的不同panel时可能会有所不同。建议用户切换解混算法以确定哪种算法适合其特定要求和实验条件。也就是说,我们的研究表明,混合泊松算法有助于减少扩散误差,特别是在使用高度重叠染料组合的panel以及并非所有抗体都滴定的panel中。

溢出扩散误差(Spillover spreading error)和解混误差(Unmixing error)是光谱流式细胞术中的主要挑战,尤其是在高维Panel中,这些误差源于生物和技术的原因,包括荧光染料亮度、光谱重叠、仪器配置和对照质量等。可以通过优化的Panel设计和对照选择,使扩散误差最小化,这也是确保可靠的数据解读至关重要的一步。贝克曼库尔特生命科学专有的混合泊松算法,使用LSM结果作为初始参数估计,然后结合了信号和噪声的泊松特性,可进一步降低数据的溢出扩散误差。
参考文献(上下滑动阅览)